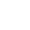Definitie van pH-meter
Een pH-meter verwijst naar een instrument dat wordt gebruikt om de pH-waarde van een oplossing te bepalen. De pH-meter werkt volgens het principe van een galvanische batterij. De elektromotorische kracht tussen de twee elektroden van de galvanische batterij is gebaseerd op de wet van Nerns, die niet alleen betrekking heeft op de eigenschappen van de elektroden, maar ook op de concentratie waterstofionen in de oplossing. Er bestaat een overeenkomstige relatie tussen de elektromotorische kracht van de primaire batterij en de waterstofionenconcentratie, en de negatieve logaritme van de waterstofionenconcentratie is de pH-waarde. De pH-meter is een veelgebruikt analytisch instrument dat veel wordt gebruikt in de landbouw, milieubescherming en industrie. De pH van de bodem is een van de belangrijkste basiseigenschappen van de bodem. Factoren zoals de temperatuur en ionsterkte van de te testen oplossing moeten in overweging worden genomen tijdens de pH-meting.
Het principe van de pH-meter
pH wordt gedefinieerd als de negatieve logaritme van de waterstofionenconcentratie in een waterige oplossing. Hoewel dit ingewikkeld klinkt, is pH in zeer eenvoudige bewoordingen een getal dat wordt gebruikt om de zuurgraad of alkaliteit van een oplossing te kwantificeren. Het getal geeft het aantal waterstofionen aan dat een specifieke stof in de oplossing kan afgeven. Binnen het pH-bereik wordt een pH van 7 als neutraal beschouwd. Oplossingen met een pH van 0-7 worden als zuur beschouwd en oplossingen boven de 7 tot 14 worden alkalische oplossingen genoemd. In biologische systemen is pH cruciaal. Dankzij de zorgvuldig ingestelde pH kunnen de meeste biomoleculen in ons lichaam uitstekend functioneren. Zelfs in een experimenteel systeem moet de vereiste pH worden gehandhaafd om nauwkeurige resultaten te verkrijgen. Daarom wordt in biologische experimenten een apparaat, een pH-meter, gebruikt om de pH nauwkeurig te controleren.
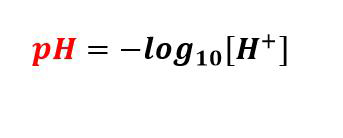
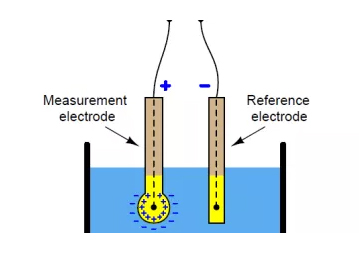
De pH-meter is een pH-gevoelige elektrode die de activiteit van waterstofionen in een oplossing meet en deze informatie doorgeeft. Het apparaat bestaat uit twee glazen buisjes, elk met een elektrode, een referentie-elektrode en een sensorelektrode. De referentie-elektrode is gemaakt van een verzadigde KCl-oplossing, terwijl de sensorelektrode een bufferoplossing met een pH van 7 bevat. De met zilverchloride bedekte zilverdraad is in deze twee oplossingen ondergedompeld. Aan het uiteinde van de sensorelektrode bevindt zich een bol van poreus glas, bedekt met silica en metaalzout.
Om de pH van de oplossing te meten, wordt de pH-meter in de oplossing gedompeld. Zodra het bolletje van de sensorelektrode de oplossing raakt, vervangen de waterstofionen in de oplossing de metaalionen op het bolletje. Deze vervanging van metaalionen zorgt ervoor dat er stroom door de metaaldraad gaat lopen, die wordt afgelezen door een voltmeter.
De pH-meter is een van de meest gebruikte apparaten in biologische laboratoria. De pH-meter analyseert routinematig de pH van buffers, oplossingen en reagentia om de juiste experimentele omstandigheden te garanderen. Om nauwkeurige metingen te garanderen, moet de apparatuur regelmatig worden gekalibreerd.
Toepassing van pH-meterdetector
Toepassing van pH-meterdetector in huishoudelijk rioolwaterzuiveringsproces

Toepassing van pH-meter bij de behandeling van galvanisch afvalwater

Toepassing van online pH-meter in de industrie

Kalibratie van de pH-meter
Plaatsingstijd: 15-12-2021